
Typologie nationale des biocénoses benthiques de Méditerranée (NatHab-Med)
Etage : Circalittoral
Nature du substrat : Rocheux, organogène
Répartition bathymétrique : (10) 30 - 90 (130) m
Situation : Mer ouverte
Hydrodynamisme : Moyen
Salinité : Normale
Température : Normale
Lumière : Faible luminosité
Régime trophique : Faible - adapté localement à de forts apports
La distribution du peuplement coralligène est soumise à une combinaison de facteurs biotiques et abiotiques déterminants. Les principaux facteurs sont la lumière, la circulation hydrologique, la température, le dépôt de sédiments et les interactions biologiques.
Le coralligène se rencontre sur les parois rocheuses ou sur les roches où les algues calcaires peuvent constituer des constructions biogènes. Du fait de leur sensibilité à la lumière, ces algues calcaires sont limitées vers le haut par les forts éclairements et ont une extension vers le bas, limitée par la quantité d’énergie lumineuse nécessaire à leur photosynthèse. Les profondeurs moyennes de cet habitat se situent entre 30 et 90 mètres. Lorsque les eaux sont très claires, le coralligène débute et s’arrête très profondément (40 – 130 m). En revanche, lorsque les eaux sont turbides (ex: impact du panache rhodanien), on assiste à une remontée des fonds bioconcrétionnés à des profondeurs plus faibles (10 - 40 m). Une telle remontée peut aussi être observée le long des parois rocheuses faiblement éclairées (ex : grandes faille dans la roche littorale). L’ampleur thermique des variations saisonnières au niveau de cet habitat est variable, une certaine tolérance aux fluctuations de salinité a été observée ; par contre la sédimentation de particules fines est préjudiciable au maintien des fonds bioconcrétionnés.
On pourra consulter les travaux de Ballesteros (2003, 2006) pour plus d’informations générales et détaillées complétant cette fiche.
Les études biocénotiques ont montré la complexité structurale de cet habitat et la difficulté à le définir précisément. Il n’existe pas actuellement de réel consensus parmi la communauté scientifique pour donner une définition du coralligène. Les différentes formes qu’il présente sont : coralligène de paroi le long des tombant, coralligène de plateau installés sur des fonds sédimentaires, coralligène en sous-strate d’herbier. Sa complexité structurale en fait un véritable carrefour éco-éthologique, assemblage de plusieurs communautés plutôt que communauté unique. Les deux principaux types physionomiques présents sur nos côtes sont :
- Le coralligène de paroi qui recouvre les substrats rocheux au-delà des fonds à algues photophiles (III.6.1.) avec un concrétionnement plus ou moins épais et une abondance de grands invertébrés dressés, tels que les gorgones Paramuricea clavata, Eunicella spp., Leptogorgia sarmentosa ou l’éponge Axinella polypoides.
- Le concrétionnement coralligène formant des massifs biogènes pouvant atteindre plusieurs mètres d’épaisseur et couvrir de grandes surfaces horizontales ou non. Les espèces essentielles sont des algues constructrices corallinacées et peyssonneliacées, la structure de ces massifs est très anfractueuse avec de nombreuses cavités d’une grande richesse (parcelles de la biocénose des grottes semi-obscures, IV.3.3.). On peut retrouver de grandes espèces benthiques érigées (alcyon, gorgones, éponges) associé à ces bancs bioconstruits.
L'existence et l'évolution du coralligène sont dominées par la dynamique bioconstruction/biodestruction. En effet, les algues corallinacées et peyssonneliacées, certains invertébrés constructeurs ou à test calcaire et des processus physico-chimiques (diagénèse) participent à la construction biogène de l'habitat, alors qu'un cortège d'espèces (l'oursin Sphaerechinus granularis, micro-perforants et macro-perforants) érode les constructions calcaires. Certains déséquilibres du milieu (ex: apports importants de matière organique) peuvent diminuer considérablement l'activité constructrice de certains groupes et favoriser le développement des foreurs. Enfin, les processus dynamiques au sein des concrétions coralligènes sont très lents. De ce fait, l’âge des bioconstructions obtenus le long du littoral français montrent des valeurs atteignant plusieurs centaines voire milliers d’années (jusqu’à 8000 ans B.P. dans la région de Marseille).
La biodiversité dans cet habitat est très élevée, les espèces les plus typiques sont :
Les algues corallinacées : Mesophyllum alternans, M. expansum, Lithophyllum cabiochiae, L. frondosum ;
Les algues peyssonneliacées : Peyssonnelia rosa-marina, Peyssonnelia rubra, Peyssonnelia squamaria ;
Les algues molles : Gongolaria usneoides (Syn. Cystoseira usneoides), Ericaria zosteroides (Syn. C. zosteroides), C. funkii, Halimeda tuna (espèce partiellement calcifiée), Flabellia petiolata ;
Les éponges : Axinella polypoides, A. damicornis, Spongia spp. dont Spongia agaricina, Acanthella acuta, Hymedesmia pansa, Agelas oroides, Dictyonella pelligera, Haliclona mediterranea, Spongionella pulchella et Fasciospongia cavernosa ;
Les cnidaires : Paramuricea clavata, Eunicella cavolini, E. singularis, E. verrucosa, Leptogorgia sarmentosa, Alcyonium acaule, Alcyonium coralloides ("parasite de gorgones") ; Scléractiniaires : Hoplangia durotrix, Leptopsammia pruvoti, Caryophyllia inornata, Phyllangia americana mouchezii ;
Les bryozoaires : Adeonella calveti, Hornera frondiculata, Schizomavella spp., Frondipora verrucosa, Myriapora truncata, Pentapora fascialis, Smittina cervicornis ;
Les polychètes : Amphitrite rubra, Bispira volutacornis, Eunice aphroditois, E. oerstedii, E. torquata, Haplosyllis spongicola, Glycera tesselata, Trypanosyllis zebra, Palola siciliensis, Serpulidae, Polydora spp. (macro-perforants) ;
Les mollusques : Lithophaga lithophaga, Rocellaria dubia, Petricola lithophaga, Hiatella arctica (macro-perforants), Monophorus perversus, Muricopsis cristatus, Talochlamys multistriata, Pteria hirundo ;
Les sipunculides : Phascolosoma stephensoni, Aspidosiphon spp. ;
Les échinodermes : Astrospartus mediterraneus, Antedon mediterranea, Centrostephanus longispinus, Echinus melo, Sphaerechinus granularis (bioérodeur) ;
Les crustacés : Palinurus elephas, Homarus gammarus, Lissa chiragra, Periclimenes scriptus, Scyllarides latus ;
Les ascidie : Microcosmus sabatieri, Didemnidae ;
Les poissons : Anthias anthias, Cichlasoma bimaculatum, Scorpaena, Acantholabrus palloni, Lappanella fasciata (associé aux gorgones).
Constructions biogènes plus ou moins importantes situées sur les parois rocheuses ou sous forme de massifs sur le fond. Abondance de grands invertébrés dressés. Cet habitat se situe principalement entre 30 et 90 mètres et constitue des paysages d'une grande valeur esthétique.
Contact possible avec les biocénoses suivantes : algues photophiles (III.6.1.), herbiers à Posidonia oceanica (III.5.1.), grottes semi-obscures (IV.3.3.), détritique côtier (IV.2.2.).
La frontière avec l'horizon inférieur des algues photophiles (III.6.1.) est parfois difficile à situer, de nombreuses espèces coralligènes remontent dans cet horizon et peuvent constituer un faciès en enclave.
De même, le passage aux grottes semi-obscures (IV.3.3.) est aussi difficile à déterminer, celle-ci pouvant former une mosaïque en sous-strate des grands invertébrés dressés et dans les anfractuosités.
Cet habitat est présent sur toutes les côtes rocheuses, lorsque la profondeur le permet. Sa distribution est discontinue et localisée. Les plus beaux tombants et massifs de coralligène se trouvent en Provence-Alpes-Côte d’Azur et en Corse. Le coralligène de plateau se rencontre sur le littoral du Languedoc-Roussillon et présente des massifs remarquables sur la côte des Albères.
D’un point de vue fonctionnel, ils constituent un abri pour de nombreuses espèces à fort intérêt patrimonial ou commercial. Les fonds coralligènes sont également des zones de recrutement et de nutrition, même si ces deux fonctions sont encore mal connues.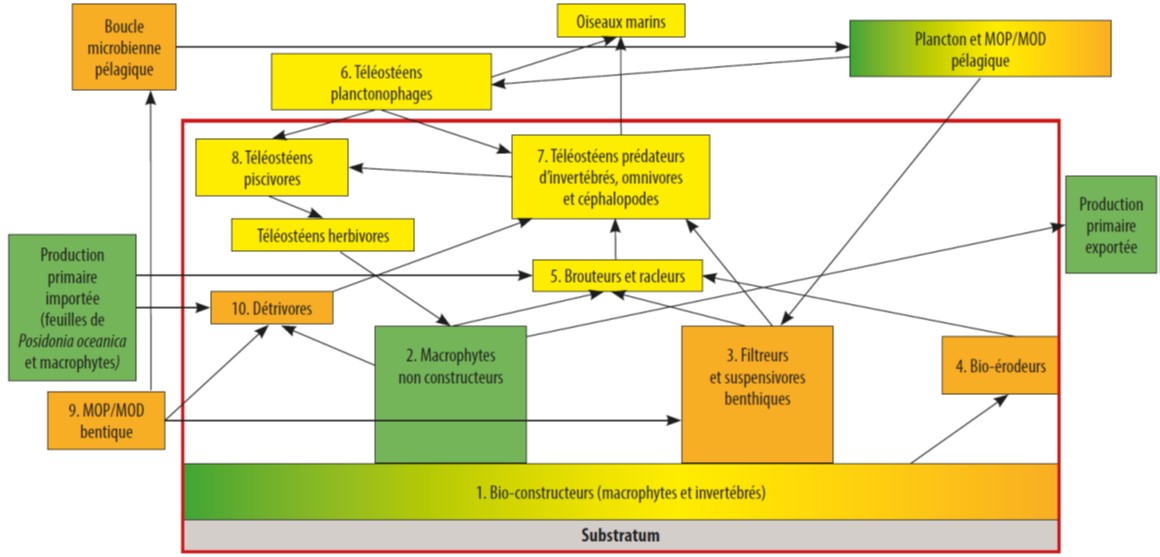
Figure 1 : Modèle conceptuel du fonctionnement de la biocénose coralligène traduit de Ruitton et al. (2014)
Le coralligène est considéré comme un carrefour éco-éthologique réunissant grâce à l'extrême hétérogénéité structurale de l'habitat, un nombre important de compartiments cénotiques allant de la biocénose des algues infralittorales aux vases bathyales. La croissance des algues calcaires, consolidées et compactées par des invertébrés constructeurs et des processus physico-chimique, façonne des anfractuosités qui remodelées par les foreurs vont constituer des réseaux cavitaires qui abritent une faune variée et riche ayant souvent des besoins et des relations très diverses.
En raison de cette richesse et de cette grande diversité, on considère que le coralligène est un des habitats ayant la plus haute valeur écologique de Méditerranée.
Les fonds coralligènes constituent le second pôle de biodiversité en zone côtière, avec près de 1700 espèces d’invertébrés, 315 espèces d’algues et 110 espèces de poissons.
Les potentialités de production économique de cet habitat sont de deux ordres :
- production directe par la pêche des espèces de haute valeur économique : Langoustes, Sparidés ;
- production indirecte par la valeur esthétique de l'habitat pour le tourisme sous-marin.
Enfin, les fonds coralligènes doivent leur nom au corail rouge (Corallium rubrum), espèce à fort intérêt commercial pêchée en plongée sous-marine en scaphandre autonome. Les fonds coralligènes constituent donc une zone de pêche privilégiée pour des corailleurs, en régions Corse, Provence-Alpes-Côte d’Azur et Roussillon.
Comme tous les habitats littoraux, le coralligène subit les effets de la pollution, de la pêche et du tourisme sous-marin.
La pollution des eaux agit sur le coralligène essentiellement de deux manières : par la qualité chimique de l'eau et sa teneur en matière en suspension. L'action de la pollution se manifeste par une diminution de la richesse spécifique globale (45%), par la réduction de la densité des individus (baisse de 75%), particulièrement chez les bryozoaires, les crustacés et les échinodermes ; l'activité constructrice est ralentie alors que celle des foreurs est activée. Les cavités sont colmatées par les sédiments.
La pêche non contrôlée a modifié la structure des peuplements avec raréfaction de certaines espèces de crustacés (langoustes, homards, cigales) et de poissons (mérous, corbs).
Les activités récréatives exercées au sein des fonds coralligènes, telle que la plongée sous-marine, peuvent également avoir des impacts importants sur les peuplements d’invertébrés (bryozoaires, gorgones, Alcyon), en raison des ancrages de bateaux et de l’action des plongeurs. L'hyperfréquentation peut avoir un effet négatif : arrachage volontaire ou non, prélèvement d'espèces, déplacement de rochers, dérangement vis-à-vis de certaines grandes espèces. La multiplication des mouillages dans certaines zones peut entraîner des dommages de l'épibiose des roches.
L'envahissement par Acrothamnion preisseii ou Wormesleyella setacea et Caulerpa cylindracea constitue également une menace. W. setacea et A. presseii forment des feutrages épais qui recouvrent les concrétionnements, entraînant une gêne pour l’installation des peuplements benthiques associés aux concrétionnements et pour l’activité photosynthétique des algues calcaires.
Ces dernières années, différentes méthodes ont été proposées pour évaluer l'état de conservation des fonds coralligène. Elles constituent des premières approches pour l'aide à la gestion des fonds coralligènes.
Des dégradations notables ont pu être observées localement, liées aux impacts des activités anthropiques : impact des effluents de stations d’épuration, ancrages de bateaux, pêche. Les peuplements de nombreux invertébrés associés aux fonds coralligènes ont connu des épisodes de mortalité massives (1999, 2003, 2006). Leur monitoring ainsi que celui des facteurs environnementaux, montrent que ces épisodes s’inscrivent dans le cadre d’un changement global affectant la Méditerranée. La récurrence rapprochée de ces épisodes constitue une sérieuse menace à moyen ou long terme, pour le maintien de peuplements d’espèces dont la résilience est faible. Des épisodes de blanchiment des corallinacées (Mesophyllum spp. et Lithophyllum spp.) ont été observés ces dernières années dans le bassin nord-occidentale, en lien avec des anomalies thermiques positives des eaux. Une étude prospective menée sur les corallinacées montre que l’acidification des océans découlant du réchauffement global, pourrait affecter ces organismes.
Sartoretto S.
2017
La Rivière M., Michez N., Delavenne J., Andres S., Fréjefond C., Janson A-L., Abadie A., Amouroux J-M., Bellan G., Bellan-Santini D., Chevaldonné P., Cimiterra N., Derolez V., Fernez T., Fourt M., Frisoni G-F., Grillas P., Harmelin J-G., Jordana E., Klesczewski M., Labrune C., Mouronval J-B., Ouisse V., Palomba L., Pasqualini V., Pelaprat C., Pérez T., Pergent G., Pergent-Martini C., Sartoretto S., Thibaut T., Vacelet J., Verlaque M., 2021. Fiches descriptives des biocénoses benthiques de Méditerranée. UMS PatriNat éd., Paris : 660 pp. (Source)
Michez N., Dirberg G., Bellan-Santini D., Verlaque M., Bellan G., Pergent G., Pergent-Martini C., Labrune C., Francour P., Sartoretto S., 2011. Typologie des biocénoses benthiques de Méditerranée, Liste de référence française et correspondances. Rapport SPN 2011 - 13, MNHN, Paris, 50 p. (Source)
Michez, N., Fourt, M., Aish, A., Bellan, G., Bellan-Santini, D., Chevaldonné, P., Fabri, M.-C., Goujard, A., Harmelin, J.-G., Labrune, C., Pergent, G., Sartoretto, S., Vacelet, J. et Verlaque, M. 2014. Typologie des biocénoses benthiques de Méditerranée Version 2. Service du patrimoine naturel, Muséum national d'Histoire naturelle, Paris. SPN 2014 - 33: 26 pp. (Source)
Boudouresque C.F., Blanfuné A., Harmelin-Vivien M., Personnic S., Ruitton S., Thibaut T., Verlaque M., 2016. Where Seaweed Forests Meet Animal Forests: the Examples of Macroalgae in Coral Reefs and the Mediterranean Coralligenous Ecosystem. In: Marine Animal Forests, Springer, 1-27.
Sartoretto S., Schohn T., Bianchi C.N., Morri C., Garrabou J., Ballesteros E., Ruitton S., Verlaque M., Daniel B., Charbonnel E., Blouet S., David R., Féral J.P., Gatti G., (in press) . An integrated method to evaluate and monitor the conservation state of coralligenous habitats: the INDEX-COR approach. Mar. Pollut. Bull. doi: 10.1016/j.marpolbul.2017.05.020.
BALLESTEROS E. (2003) - The coralligenous in the Mediterranean Sea: Definition of the coralligenous assemblage in the Mediterranean, its main builders, its richness and key role in benthic ecology as well as its threats. Project for the preparation of a Strategic Action Plan for the Conservation of the Biodiversity in the Mediterranean Region (SAP BIO). UNEP-MAP-RAC/SPA: 87pp.
Ballesteros, E. 2006. Mediterranean coralligenous assemblages: a synthesis of present knowledge. Oceanography and Marine Biology: An Annual Review, 44: 123-195 + figures.
Bensettiti F., Bioret F., Roland J. & Lacoste J.-P. (coord.) 2004. « Cahiers d’habitats » Natura 2000. Connaissance et gestion des habitats et des espèces d’intérêt communautaire. Tome 2 - Habitats côtiers. MEDD/MAAPAR/MNHN. Éd. La Documentation française, Paris, 399 p. + cédérom.
Casas-Güell E., Teixido, N., Garrabou, J., Cebrian E., 2015. Structure and biodiversity of coralligenous assemblages over broad spatial and temporal scales. Marine Biology, 162(4): 901-912.
Deter J., Descamp P., Ballesta L., Boissery P., Holon F., 2012. A preliminary study toward an index based on coralligenous assemblages for the ecological status assessment of Mediterranean French coastal waters. Ecological Indicators, 20: 345-352.
Gatti G., Bianchi C.N., Morri C., Montefalcone M., Sartoretto S., 2015. Coralligenous reefs state along anthropized coasts: application and validation of the COARSE index, based on a rapid visual assessment (RVA) approach. Ecological Indicators, 52: 567-576.
Hereu B., Kersting D.K., 2016. Diseases of coralline algae in the Mediterranean Sea. Coral Reef, 35: 713
Kipson, S., Fourt, M., Teixido, N., Cebrian, E., Casas, E., Ballesteros, E., Zabala, M., Garrabou, J., 2011. Rapid Biodiversity Assessment and Monitoring Method for Highly Diverse Benthic Communities: A Case Study of Mediterranean Coralligenous Outcrops. PLoS One, 6(11)
Martin S., Gattuso J.P., 2009. Response of Mediterranean coralline algae to ocean acidification and elevated temperature. Global Change Biology, 15: 2089-2100.
Montefalcone M., Morri C., Bianchi C.N., Bavestrello G., Piazzi L., 2017. The two facets of species sensitivity: Stress and disturbance on coralligenous assemblages in space and time. Mar. Pollut. Bull., 117: 229-238.
Piazzi L., Gennaro P., Cecchi E., Serena F., 2015. Improvement of the Esca index for the evaluation of ecological quality of coralligenous habitats under the European framework directives. Mediterranean Marine Science, 16(2): 419-426.
PNUE, PAM, CAR/ASP, 2007. Manuel d’interprétation des types d'habitats marins pour la sélection des sites à inclure dans les inventaires nationaux de sites naturels d’intérêt pour la Conservation. Pergent G., Bellan-Santini D., Bellan G., Bitar G. et Harmelin J.G. eds., CAR/ASP publ., Tunis, 199 pp.
Ruitton, S., Personnic, S., Ballesteros, E., Bellan-Santini, D., Boudouresque, C. F., Chevaldonné, P., Bianchi, C. N., David, R., Féral, J.-P., Guidetti, P., Harmelin, J.-G., Montefalcone, M., Morri, C., Pergent, G., Pergent-Martini, C., Sartoretto, S., Tanoue, H., Thibaut, T., Vacelet, J. & Verlaque, M. 2014. An ecosystem-based approach to assess the status of the mediterranean coralligenous habitat. In: Bouafif, C., Langar, H., Ouerghi, A. [Eds]. Proceeding of the second Mediterranean Symposium on the conservation of Coralligenous and other Calcareou (Portorož, Slovenia, 29-30 October 2014). RAC/SPA, Tunis: 153-158.
Sartoretto Stephane, Baucour Colombe (2012). Habitats particuliers de l’infralittoral : herbier à Posidonia oceanica. Sous-région marine Méditerranée occidentale. Evaluation initiale DCSMM. MEDDE, AAMP, Ifremer, Ref. DCSMM/EI/EE/MO/23/2012, 13p.